Sifat koligatif larutan adalah suatu sifat yang hanya dipengaruhi oleh banyaknya zat yang terlarut, bukan jenis zat pelarut. Sebagai contoh, jika 0.25 molal larutan glukosa memiliki titik didih 100.13 °C, maka 0.25 molal larutan sukrosa juga memiliki titik didih sebesar 100.13 °C. Padahal sukrosa dan glukosa adalah zat yang berbeda. Inilah yang dimaksud sebagai sifat koligatif larutan. Karena hanya bergantung dari banyaknya zat, sifat ini sering disebut sebagai sifat fisika dari larutan.
Sebelum memasuki materi sifat koligatif larutan, Kita akan berkenalan dengan ukuran konsentrasi zat. Yaitu, ukuran yang membedakan kepekatan suatu zat dalam suatu larutan. Ada beberapa yang cukup penting, seperti Molaritas, molalitas, fraksi mol, persen massa, persen volume, ppm dan lain sebagainya. Kita telah mengenal beberapa diantaranya pada materi kimia larutan pada kelas sebelumnya.
Beberapa sifat koligatif larutan yang cukup dikenal adalah penurunan tekanan uap. Pada umumnya tekanan uap jenuh dari zat murni lebih tinggi daripada tekanan uap jenuh larutan. Peningkatan titik didih, pada umumnya titik didih zat murni lebih rendah dari pada titik didih larutan. Penurunan titik beku, pada umumnya titik beku zat murni lebih tinggi bila dibandingkan dengan titik beku larutan. Dan, tekanan osmotik, pada umumnya, tekanan osmotik dari zat murni lebih rendah bila dibandingkan dengan tekanan osmotik larutan.
Menggunakan besaran konsentrasi larutan, kita bisa menghitung besaran sifat koligatif larutan tersebut. Nah, pada seri ini, Kita akan belajar untuk menjawab beberapa soal terkait dengan konsentrasi larutan dan sifat koligatif larutan. Setiap soal memiliki jawaban dalam bentuk video. Video tersebut tersedia di channel @CatatanSiRebiaz. Jika kamu memiliki pertanyaan, silakan tulis pada kolom komentar. Mungkin saja, pertanyaan kamu akan menjadi bahan pada video tutorial selanjutnya.
Sebelum memasuki materi sifat koligatif larutan, Kita akan berkenalan dengan ukuran konsentrasi zat. Yaitu, ukuran yang membedakan kepekatan suatu zat dalam suatu larutan. Ada beberapa yang cukup penting, seperti Molaritas, molalitas, fraksi mol, persen massa, persen volume, ppm dan lain sebagainya. Kita telah mengenal beberapa diantaranya pada materi kimia larutan pada kelas sebelumnya.
Beberapa sifat koligatif larutan yang cukup dikenal adalah penurunan tekanan uap. Pada umumnya tekanan uap jenuh dari zat murni lebih tinggi daripada tekanan uap jenuh larutan. Peningkatan titik didih, pada umumnya titik didih zat murni lebih rendah dari pada titik didih larutan. Penurunan titik beku, pada umumnya titik beku zat murni lebih tinggi bila dibandingkan dengan titik beku larutan. Dan, tekanan osmotik, pada umumnya, tekanan osmotik dari zat murni lebih rendah bila dibandingkan dengan tekanan osmotik larutan.
Menggunakan besaran konsentrasi larutan, kita bisa menghitung besaran sifat koligatif larutan tersebut. Nah, pada seri ini, Kita akan belajar untuk menjawab beberapa soal terkait dengan konsentrasi larutan dan sifat koligatif larutan. Setiap soal memiliki jawaban dalam bentuk video. Video tersebut tersedia di channel @CatatanSiRebiaz. Jika kamu memiliki pertanyaan, silakan tulis pada kolom komentar. Mungkin saja, pertanyaan kamu akan menjadi bahan pada video tutorial selanjutnya.
SOAL SIFAT KOLIGATIF LARUTAN
- 31.24 gram kristal Na₂SO₄ dilarutkan ke dalam 320 ml air. Berapakah molaritas dari larutan tersebut?
- A. 0.125 M
- B. 0.3750 M
- C. 0.6875 M
- D. 0.8235 M
- E. 1.2 M
- 36 gram gula sederhana (C₆H₁₂O₆) dilarutkan ke dalam 250 gram air. Berapakah molalitas glukosa tersebut dalam larutan?
- A. 0.1 molal
- B. 0.2 molal
- C. 0.4 molal
- D. 0.6 molal
- E. 0.8 molal
- Sebanyak 36 gram glukosa, C₆H₁₂O₆ dilarutkan ke dalam 216 gram air. Hitunglah fraksi mol glukosa dalam larutan tersebut?
- A. 0.016
- B. 0.020
- C. 0.024
- D. 0.028
- E. 0.032
- Suatu larutan 350 gram beriss 12 % (m/s) massa glukosa, C₆H₁₂O₆. Pertanyaanya adalah, berapakah massa glukosa pada larutan tersebut?
- A. 42 gram
- B. 56 gram
- C. 64 gram
- D. 72 gram
- E. 90 gram
- Suatu obat kumur tertera 16 % (v/v) alkohol. Jika volume dari botol obat kumur tersebut berisi 250 ml. Berapakah volume dari alkohol tersebut?
- A. 15 ml
- B. 25 ml
- C. 40 ml
- D. 45 ml
- E. 50 ml
- Tekanan uap jenuh larutan 180 gr zat x dalam 432 gram air adalah 40.512 mmHg. Pada suhu yang sama, hitung massa molekul relatif zat x, jika tekanan uap air murni adalah 42.2 mmHg?
- A. 75 gr/mol
- B. 96 gr/mol
- C. 125 gr/mol
- D. 150 gr/mol
- E. 180 gr/mol
- Titik didih larutan glukosa 0.75 molal adalah 100.39 °C. Berapakah titik didih dari larutan sukrosa 0.25 molal?
(Tetapan kenaikan titik didih air, Kb = 0.52 °C/molal)- A. 100.13 °C
- B. 100.26 °C
- C. 100.36 °C
- D. 100.48 °C
- E. 100.52 °C
- Suatu larutan membeku pada -4 °C. Pertanyaannya adalah, berapakah titik didih larutan tersebut?
(Tetapan kenaikan titik didih air, Kb = 0.52 °C/molal, Tetapan penurunan titik beku air, Kf = 1.86 °C/molal)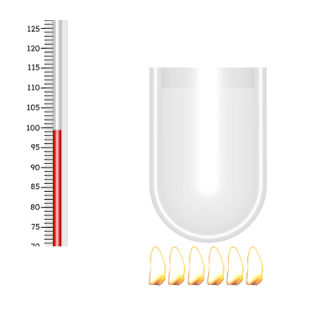
- A. 100.08 °C
- B. 100.26 °C
- C. 100.85 °C
- D. 101.12 °C
- E. 101.25 °C
- 13.75 gram garam CaCl₂ dilarutkan ke dalam 800 ml air. Berapakah, titik beku larutan tersebut?

- A. -0.96
- B. -0.87 °C
- C. -0.60
- D. -0.48
- E. -0.36
- Sebanyak 82.8 gram zat dilarutkan dalam 600 ml air membeku pada suhu -2.79 °C. Berapakah, massa molekul relatif zat tersebut?
- A. 36 gr/mol
- B. 48 gr/mol
- C. 67 gr/mol
- D. 92 gr/mol
- E. 108 gr/mol

- Sebanyak 2.9 gram suatu zat non-elektrolit dilarutkan ke dalam air hingga volume larutan 750 ml. Ternyata, pada suhu 27 °C larutan yang terjadi memiliki tekanan osmotik 1.67 atm. Berapakah massa molekul relatif zat tersebut?
- A. 36 gr/mol
- B. 58 gr/mol
- C. 78 gr/mol
- D. 86 gr/mol
- E. 92 gr/mol
Komentar
Posting Komentar